آنتروپی چیست؟(1)
آنتروپی یا بی نظمی (1)
شاید برای شما این سؤالات پیش آمده باشد که آنتروپی چیست؟
این خاصیت، شیمیایی است یا فیزیکی؟
حالت ماده در در صفر درجه کلوین با استفاده از آنتروپی چگونه توصیف می شود؟
آیا آنتروپی به انرژی ماده ارتباطی دارد؟ و
ده ها سؤال دیگر که در برخورد به آنتروپی ممکن است با آن روبرو شویم...
آنتروپی:
آنتروپی یک مفهوم شیمیایی است که توضیح دقیق آن قدری مشکل است؛ کلمه آنتروپی در جاهای دیگری هم کاربرد دارد، اما ما در این مقاله به بحث ترمودینامیکی (علمی که راجع به گرما و تغییرات آن است) آن و فرایندهای فیزیکی و شیمیایی می پردازیم.
آنتروپی چیست؟
ما انرژی را به صورت یک نیروی محرکه برای تغییرات تعریف می کنیم، آنتروپی نیز به صورت نیروی محرکه ای برای تغییرات فیزیکی و شیمیایی (واکنش ها) است. نماد آنتروپی (S) به انرژی مربوط می شود اما نوع دیگری از انرژی است.

تغییرات فیزیکی و شیمیایی که اندازه می گیریم، فقط با مفهوم انرژی نمی توانند توصیف شوند.
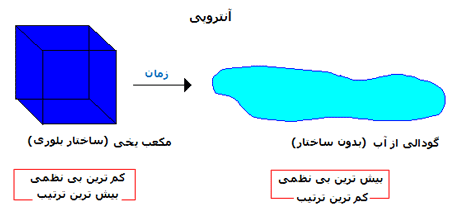
یک مفهوم متفاوت از اندازه گیری آنتروپی به تغییرات خود به خودی در سیستمی مانند انبساط گاز در یک فضای خالی (خلأ) و انتقال گرما از یک جسم داغ به جسمی سرد نیاز دارد.
این تغییرات باعث افزایش آنتروپی برای سیستم های ذکر شده می شوند؛ اما انرژی به درون یا بیرون از این سیستم ها انتقال پیدا نمی کند.
مفهوم آنتروپی به قانون های دوم و سوم ترمودینامیک مربوط است.
آنتروپی به توزیع انرژی حالت های انرژی مجموعه ای از مولکول ها مربوط است
و این جنبه از آنتروپی معولا در مکانیک آماری مورد بحث قرار می گیرد که اگر به رشته فیزیک در دانشگاه علاقه مند باشد، مطالب جامع راجع به آنتروپی را خواهید آموخت.
قانون دوم ترمودینامیک:
وقتی سیستمی مقدار انرژی q را در دمای ثابت T به دست می آورد، تغییرات آنتروپیS با معادله زیر افزایش پیدا می کند:
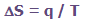
آنتروپی، تابع حالتی است که مستقل از مسیری که تغییرات در آن اتفاق افتاده اند، تنها به حالت اولیه و نهایی سیستم بستگی دارد. البته فرض می شود که تغییرات در یک بازه زمانی طولانی اتفاق می افتند یا در شرایط تقریبا تعادلی یا برگشت پذیر.
اگر تغییرات با سرعت زیاد در یک وضعیت برگشت ناپذیر اتفاق بیفتند، آنتروپی مقدار بزرگ تر از آن چه که معین شده است، خواهد داشت؛ زیرا افزایش دما یکنواخت نیست.
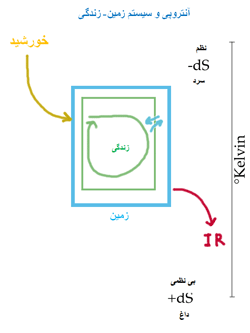
طبیعت، گرایش به افزایش آنتروپی S دارد و سیستم با همین گرایش، تغییر می کند. این گونه تغییرات، فرایندهای خود به خودی نامیده می شوند. شاید این جمله را شنیده باشید که جهان در حال انبساط است و گرایش به بی نظمی دارد؛ این نشان می دهد که تمام انرژی های اطراف ما به صورتی از انرژی (که گرما است) تبدیل می شوند که قابل برگشت نیست!
بنابراین نیروی محرک برای فرایند خود به خودی در یک سیستم منزوی (سیستمی که با محیط بیرون خود، مبادله کار و گرما نداشته باشد) افزایش در آنتروپی آن است.
این عبارت، یک بیان پذیرفته شده از قانون دوم ترمودینامیک است؛ البته از صورت رسمی این جملات ناراحت نشوید، در ابتدا گفتیم که درک مفهوم آنتروپی برای اکثر مردم سخت است!